本講座が開講以来これまで推進してきた骨代謝学と口腔科学、そして私が高柳研で学んできた骨免疫学の伝統を継承しつつも、悪性腫瘍、血管疾患、神経疾患など現代医療が抱える喫緊の課題へと研究プロジェクトを展開してゆくことで、難治性疾患の革新的な治療・予防法の開発に繋げることを目標にしています。
1. 非免疫系による抗がん効果の解明
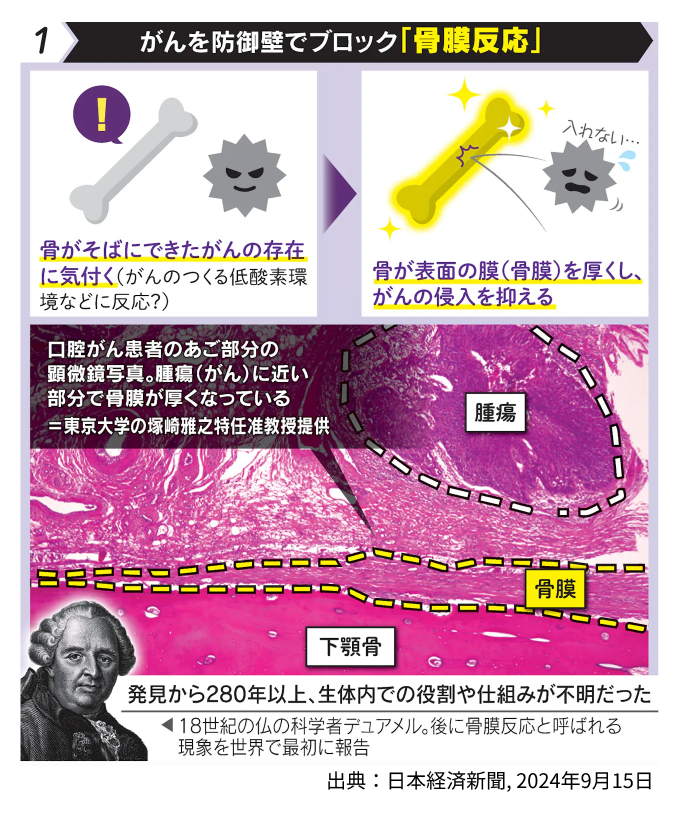
免疫系による抗がん効果の研究は免疫チェックポイント阻害薬の臨床応用をもたらし、がん患者の生命予後を大きく改善しています。しかしながら、非免疫系に宿る抗がん効果に関してはこれまでほとんど不明でした。私たちは、口腔がんの顎骨への近接に対し、骨膜のストロマ(間質)細胞がプロテアーゼ阻害因子を産生することでコラーゲンの防御壁を作り、腫瘍の進展を物理的に抑制するというユニークな現象を見出し、非免疫系ストロマ細胞による全く新しい抗腫瘍機構「stromal defense against cancer: SDAC」という概念を提唱しました(Nakamura, Tsukasaki* et al., Nature, 2024)。本概念をさらに発展させ、他の腫瘍におけるSDAC機構の検証や、非免疫系が腫瘍を認識する詳細な分子メカニズムの解明を進めることで、悪性腫瘍に対する革新的な治療・予防戦略の創生を目指します。
2. 動脈硬化・血管石灰化の研究
動脈硬化性疾患による死亡者数の合計は悪性腫瘍と同程度であり、国民の健康寿命を脅かす主要因となっています。動脈硬化が進行すると血管が異所性に石灰化し、血管の可動性低下による心負荷増加や石灰化片による血管塞栓・破損を引き起こすことで患者の生命予後を顕著に増悪します。しかしながら、動脈硬化病変が石灰化病変へと移行するプロセスの詳細な分子メカニズムは不明な点が多く、有効な予防・治療法も未だ確立されていません。免疫細胞が血管組織に浸潤し、異所性に硬組織が形成される病態を鑑みると、骨免疫学の視点なくして動脈硬化・血管石灰化の全容は理解できないと考えられます。動脈硬化・血管石灰化のメカニズムを骨免疫血管連関の観点から解析し、新たな予防・治療法の開発を目指しています。

3. 炎症性骨疾患の病態解明
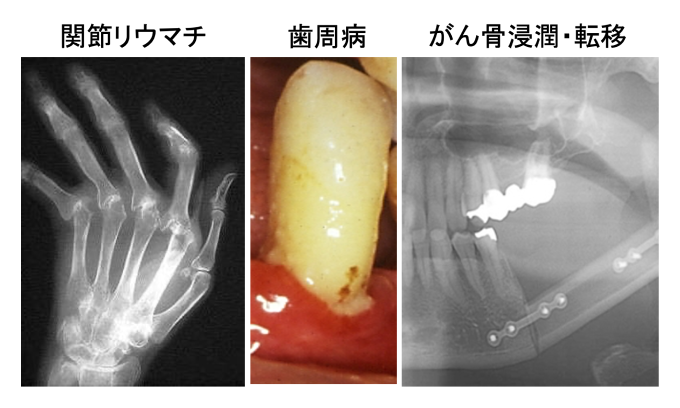
感染、腫瘍、自己免疫などに伴う免疫系の過剰な活性化は骨代謝バランスを破綻させ、炎症性骨破壊を引き起こします。私たちはこれまで、歯周病、関節リウマチ、がん骨浸潤・転移をモデルとして、炎症性骨破壊の病態を司る免疫と骨の連関を研究して参りました(Tsukasaki et al., JBMR 2017, Tsukasaki et al., Nature Communications 2018, Tsukasaki et al., Nature Reviews Immunology 2019, Yan, et al., Nature Immunology 2022, Ando, Tsukasaki* et al., IJOS 2024, Nakamura, Tsukasaki* et al., Nature, 2024)。上記の疾患に限らず、さまざまな骨疾患の更なる病態解明と制御法開発を目指し、ヒト検体を用いたオミクス解析と遺伝子改変マウスによるノックアウト実験を組み合わせたアプローチで研究を進めています。
4. RANKL・RANK・OPG生物学
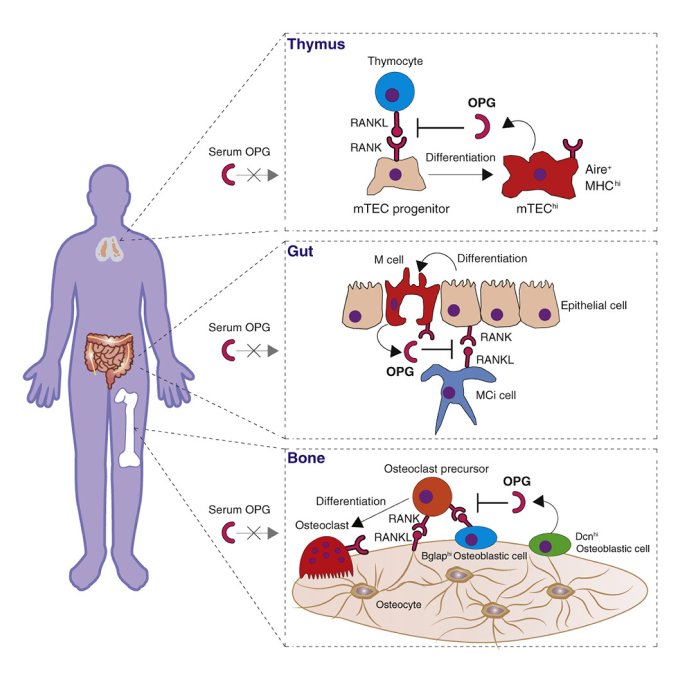
1998年に雪印乳業と当講座が共同でクローニングしたRANKL(Yasuda et al., PNAS 1998)は、骨代謝の中枢因子であるのみならず、胸腺、リンパ節、腸管粘膜など免疫組織の発生や恒常性維持にも重要な役割を果たすことが明らかになっています(Tsukasaki et al., Nature Reviews Immunology 2019)。私たちはこれまでに、細胞種・状況依存的なRANKL制御領域を複数同定すると同時に(Yan, et al., Nature Immunology 2022, Yan, Tsukasaki* et al., Bone Research 2023, Ando, Tsukasaki* et al., IJOS 2024)、RANKLのデコイ受容体であるOPGのコンディショナルノックアウトマウスを世界に先駆けて作出し、OPGの骨、胸腺、腸管における産生源を特定してきました(Tsukasaki et al., Cell Reports 2017)。現在、新たに作成したユニークな遺伝子改変マウスを用いて、RANKL・RANK・OPGシステムによる生体恒常性維持および破綻機構の解明を進めています。
5. 骨格系の生理と病理
骨は運動器、造血器、ミネラル貯蔵庫、内分泌器として、脊椎動物の恒常性維持に必須の役割を果たしています。私たちは、骨吸収を担う破骨細胞の研究(Tsukasaki et al., Nature Metabolism 2020)と、骨形成を担う骨芽細胞およびその前駆細胞の研究(Tsukasaki et al., Nature Communications 2022)を推進し、骨格系制御機構の包括的な理解を目指してきました。現在は、破骨細胞の融合機構、骨芽細胞の機能的多様性、骨膜に分布する神経の機能、頭蓋骨と脳の連関に着目し、新しいプロジェクトを複数立ち上げています。
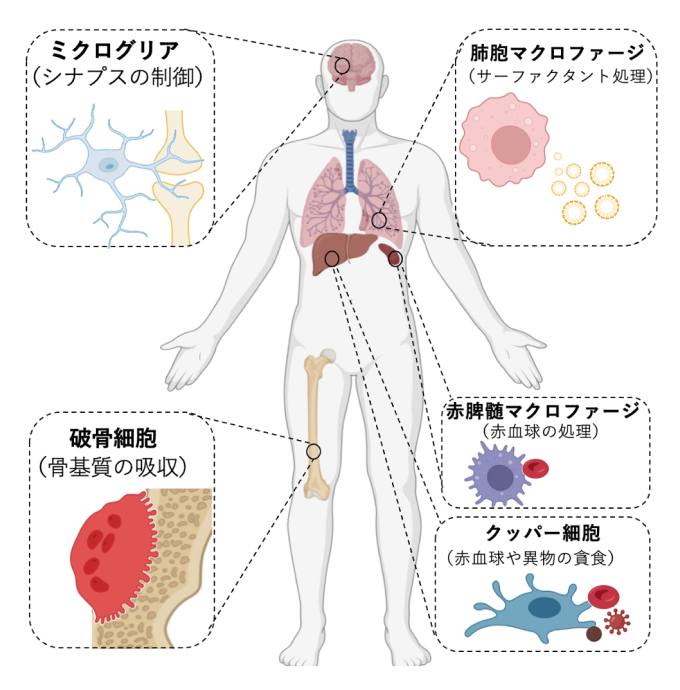
6. 組織マクロファージによる生体制御
「組織マクロファージ」は胎生期に発生後、脳を含むあらゆる臓器に分布し、臓器の発達や代謝に寄与すると考えられています。組織マクロファージの性質は、常在する臓器固有の機能と深く結びついており、例えば骨の組織マクロファージである破骨細胞は酸とプロテアーゼを分泌することで生体唯一の骨吸収細胞として機能します。脳内ミクログリアはニューロンの代謝やシナプス結合の制御に寄与し、肺胞マクロファージはサーファクタントを処理することで肺の恒常性を維持します。組織マクロファージの分化および機能は、細胞にプログラムされた転写ネットワークと、常在する組織の微小環境の双方により決定されていると考えられておりますが、その詳細なメカニズムは不明です。私たちは破骨細胞のオミクス解析から、組織マクロファージを共通して制御する新規遺伝子を同定しています。臓器別の縦糸研究に組織マクロファージという横糸を通すことで、生体制御システムの理解を深化すると同時に、ミクログリアが関与する神経疾患、肺胞マクロファージが関わる呼吸器疾患など、様々な疾患に対する治療戦略開発に向けた基盤構築を目指しています。